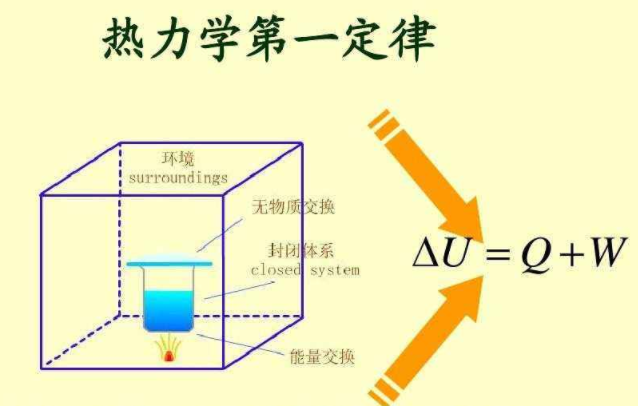
热力学第一定律的数学表达式是什么?其物理意义是什么
的有关信息介绍如下:数学表达式为:△U=Q+W;物理意义是一般情况下,加给工质的热量一部分消耗于作膨胀功,另一部分蓄存于工质内部,增加了工质的内能。热可以转变为功,功也可以转变为热,一定量的热消失时,必产生一定量的功;消耗了一定量的功时,必产生与之对应的一定量的热。
热力学第一定律是能量转化和守恒定律在热现象过程中,内能和其他形式的能相互转化的数量关系。
系统的内能增量等于系统从外界吸收的热量和外界对系统做功的和。设系统的内能变化量为△U,外界对系统做功为W,系统吸收外界的热量为Q,则有:△U=W+Q
在使用这个定律时要注意三个量的符号处理:外界对系统做功,W取正值,系统对外做功W取负值,如果系统的体积不变,则W=0;系统从外界吸热,Q取正值,系统对外界放热,Q取负值;系统的内能增加,△U取正值,系统的内能减小,△U取负值。
扩展资料
该定律经过迈尔 J.R.Mayer、焦耳 J.P.Joule等多位物理学家验证。热力学第一定律就是涉及热现象领域内的能量守恒和转化定律。
自然界一切物质都具有能量,能量有不同的表现形式,可以从一种形式转化为另一种形式,也可以从一个物体传递给另一个物体,在转化和传递过程中能量的总和不变。
假设有一封闭系统,它的内能为U1,该该系统从环境吸收热量Q,同时环境对系统做了W的功,结果使这个系统从内能为U1的始态变为内能为U2的终态。
根据能量守恒定律U2=U1+Q+W或 △U=Q+W (1-4)即为热力学第一定律的数学表达式,即系统内能的变化等于系统从环境吸收的热量加上环境对系统做的功。 当压力不变,只做体积功的条件下,热力学第一定律可以表示为△U=Q-p△v (1-5)。
通用公式 ΔU=Q+W
绝热:Q=0,ΔU=W
恒容(W=0):W=0,ΔU=QV
恒压(W=0):W=-pΔV=-Δ(pV),ΔU=Q-Δ(pV)ΔH=Qp
恒容+绝热(W=0):ΔU=0
恒压+绝热(W=0):ΔH=0
焓的定义式:H=U+pVΔH=ΔU+Δ(pV)
参考资料:百度百科-热力学第一定律